Nos elementos químicos conhecidos, os átomos podem distribuir-se em 7 níveis de energia (contendo elétrons) que são representados, em sequência, a partir do núcleo, pelas letras K, L, M, N, O, P, Q ou pelos números 1, 2, 3, 4, 5, 6, 7. Estes números são chamados de números quânticos principais, eles representm a aproximada distância do elétron ao núcleo, como também a energia do elétron. Se um elétron tem número quântico principal igual a 3, ele pertence à camada M e tem a energia desse nível.
.jpg)
Exemplo:
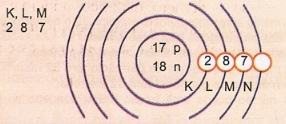
Represente, esquematicamente, o átomo de número atômico 17 e número de massa 35.
Temos: Nº de prótons: Z = 17
Z = 17 Nº de elétrons: Z = 17
A = 35 Nº de nêutrons N = A - Z = 35 - 17 = 18
Distribuição eletrônica:
Camada de valência
O nível de energia mais externo do átomo é denominado camada de valência. Assim, no átomo do exemplo anterior é a camada M. Ela pode conter, no máximo, 8 elétrons.
Subníveis de energia
Verificou-se que a radiação correspondente à energia liberada, quando um elétron passa de um nível de energia mais afastado para outro mais próximo do núcleo, é, na realidade, a composição de várias ondas luminosas mais simples. Conclui-se, então, que o elétron percorre o caminho "aos pulinhos', isto é, os níveis de energia subdividem-se em subníveis de energia.
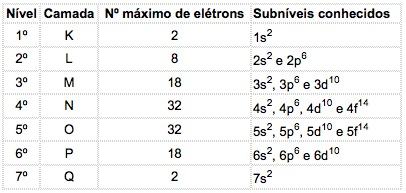
Nos átomos dos elementos conhecidos, podem ocorrer 4 tipos de subníveis, designados sucessivamente pelas letras s ("sharp"), p ("principal"), d ("diffuse") e f ("fundamental").
O número máximo de elétrons distribuído em cada subnível é:
s p d f
2 6 10 14
Notação da configuração eletrônica
Escreve-se o número quântico principal antes da letra indicativa do subnível, a qual possui um "expoente" que indica o número de elétrons contidos nesse subnível.
Exemplo: 3p5
Significado: Na camada M (número quântico principal = 3), existe o subnível p, contendo 5 elétrons.
Para se dar a configuração eletrônica de um átomo, colocam-se os elétrons, primeiramente, nos subníveis de menor energia (estado fundamental).
Exemplo: Na (Z = 11)
Na: 1s2 2s2 2p6 3S1
Deve-se observar a ordem energética dos subníveis de energia, que infelizmente não é igual à ordem geométrica. Isso porque subníveis de níveis superiores podem ter menor energia total do que subníveis inferiores.
Resumindo:
Método gráfico para ordenação dos subníveis
Descendo as diagonais, a energia vai aumentando (Diagrama de Linus Pauling).
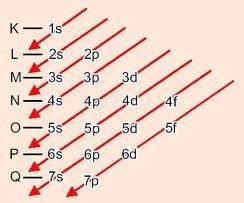
Ordem energética dos subníveis:
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s - 4f - 5d - 6p - 7s - 5f - 6d - 7p
Exemplo de distribuição eletrônica:
Átomo de ferro (Z=26).
Solução:
Escrevendo na ordem de preenchimento (energética), temos:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Escrevendo na ordem de camada (geométrica):
K: 1s2
L: 2s2 2p6
M: 3s2 3p6 3d6
N: 4s2
K L M N
2 8 13 2

Este comentário foi removido pelo autor.
ResponderExcluir