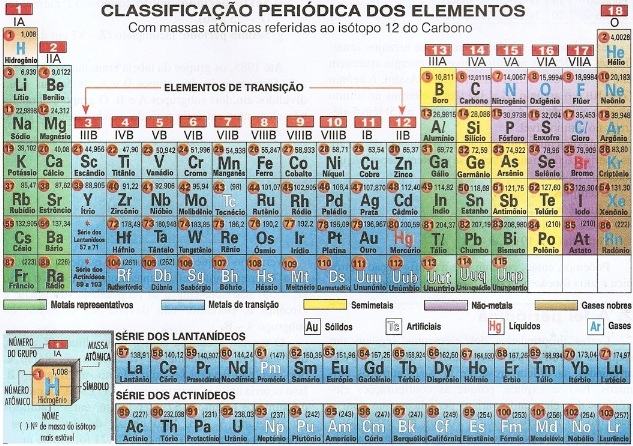
Clique para ver a tabela em tamanho real
Famílias ou grupos
Cada coluna vertical da Tabela Periódica constitui o que chamamos família ou grupo de elementos; são ao todo, dezoito.
Uma família corresponde a elementos que apresentam certa similaridade na sua estrutura eletrônica da última camada, o que acarreta certa semelhança de comportamento químico.
Os átomos de uma família apresentam:
a mesma configuração eletrônica na última (camada de valência);
propriedades químicas semelhantes.
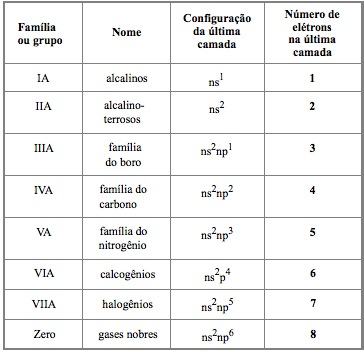
Nas configurações acima, n é o número do nível da última camada (camada de valência).
Períodos ou séries
Cada fila horizontal da tabela periódica constitui o que chamamos período ou série de elementos.
Cada período corresponde ao número de camadas eletrônicas existentes nos elementos que o constituem. Os períodos são sete (7).
Período
Camadas eletrônicas
1
1 (K)
2
2 (K, L)
3
3 (K, L, M)
4
4 (K, L, M, N)
5
5 (K, L, M, N, O)
6
6 (K, L, M, N, O, P)
7
7 (K, L, M, N, O, P, Q)
Vejamos alguns exemplos de localização na tabela periódica.
11Na = 1s2 2s2 2p6 3S1 3º período → 3 camadas
K=2 L=8 M=1 Família IA → 1 e- na camada de valência
9F = 1s2 2s22p5 2º período → 2 camadas
K=2 L=7 Família VIIA → 7 e- na camada de valência
Série dos Lantanídeos e dos Actinídeos
É o nome que recebem os dois apêndices embaixo da tabela.
Observações
a) Lantânio (La) e Actínio (Ac) não pertencem às séries.
b) Essas séries são chamadas Elementos de Transição Interna.
c) Os lantanídeos também são chamados lantanóides ou terras-raras.
d) Os actinídeos também são chamados actinóides.
e) O uso dos termos "lantanóide" e "actinóide" foi recomendado pela IUPAC.
Classificações dos elementos químicos
Uma outra classificação pode ser feita relacionando o subnível mais energético de cada elemento.
Assim temos:
Elementos
Subnível mais energético Localização
Representativos
s ou p
Grupos A e gases nobres
De transição
d
Grupos B
De transição interna
f
Lantanídeos e Actinídeos
Outra classificação importante que pode ser localizada na Tabela Periódica, é feita com base em propriedades gerais dos elementos.
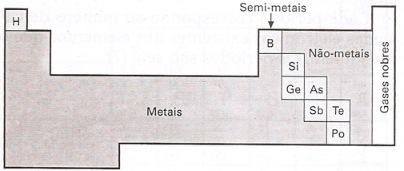
Os metais, em número de 81, são os mais numerosos elementos conhecidos.
Estão situados do centro para a esquerda da Tabela Periódica.
São bons condutores de eletricidade e calor. Apresentam um brilho típico, chamado brilho metálico: podem ser reduzidos a lâminas (maleabilidade); podem ser reduzidos a fios (ductibilidade). Apresentam, via de regra, poucos elétrons (menos de 4) na última camada. Tendem a perder elétrons; são todos sólidos (25°C), com exceção do mercúrio, que é líquido.
Os não-metais são poucos; somente 11.
Estão situados à direita da Tabela Periódica, antes da família dos gases nobres.
Em geral, são maus condutores de corrente elétrica e calor; não apresentam brilho metálico; não podem ser reduzidos a lâminas e fios. Apresentam, via de regra, muitos elétrons (mais de 4) na última camada. Tendem a ganhar elétrons; não apresentam propriedades muito uniformes.
Os semi-metais são bem poucos; só 7.
Estão situados entre os metais e os não-metais, na Tabela Periódica.
Têm propriedades intermediárias às aqui apontadas.
O hidrogênio e os gases nobres não se enquadram nesta classificação.
• Elementos químicos artificiais
Após o elemento urânio (92U), todos os elementos químicos situados na Tabela Periódica são artificiais, ou seja, não existem no nosso planeta e são produzidos em laboratório: são os elementos transurânicos.
Com número atômico inferior a 92, temos alguns poucos elementos artificiais: frâncio (87Fr), astato (85At),tecnécio (43Tc) e promécio (61Pm). Tais elementos são denominados cisurânicos.
• Elementos radioativos
Os elementos cujos isótopos mais abundantes são radioativos encontram-se, na tabela, do polônio em diante.

Nenhum comentário:
Postar um comentário