Sabemos que as quantidades de íons H+ e OH-determinam o caráter ácido-base de uma solução. Mas, para que possamos compreender melhor como se dá essa medida de acidez e basicidade de soluções, primeiro é preciso entender os mecanismos de um processo muito importante: o equilíbrio iônico da água. Observe a seguinte equação:
H2O(ℓ) H+(aq) + OH-(aq)
H+(aq) + OH-(aq)
Em estado liquido, uma pequena parte das moléculas de água se dissocia, dando origem aos íons H+ e OH- aquosos. Na reação inversa, esses mesmos íons se combinam e produzem novamente a água líquida. Assim, dizemos que o comportamento da água pura caracteriza uma situação de equilíbrio, que recebe o nome de equilíbrio iônico da água.
Por se tratar de um caso de equilíbrio iônico, podemos determinar a constante de equilíbrio da água, ou seja, a razão entre as concentrações dos seus produtos sobre a concentração dos seus reagentes. Veja:
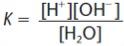
Kw = [H+][OH-]
Kw = 10-7 . 10-7 = 10-14 (a 25 °C)
Mas, por que não aparece a concentração da água no cálculo que fizemos? A resposta é simples: a concentração da água é absolutamente constante (isso pode ser facilmente compreendido se pensarmos que não existe água concentrada nem água diluída). O resultado que obtivemos a partir do cálculo é o que chamamos de produto iônico da água, representado pelo símbolo Kw (K vem de constante e w de water, água em inglês).
Perceba que, na água pura, a concentração de H+ (1 x 10-7) é igual à concentração de OH- (1 x 10-7), por isso dizemos que a água pura é neutra a temperatura ambiente. Quando, porém, a concentração de íons H+ é maior que a concentração de OH- de uma solução, dizemos que se trata de uma solução ácida. Ao contrário, quando uma solução apresenta uma concentração de OH- maior que a de H+, dizemos que ela é uma solução básica.
Quanto maior a concentração de H+ mais ácida será a solução
Quanto maior a concentração de OH- mais básica (ou alcalina) será a solução
Quando as concentrações de H+ e OH- são iguais, a solução será neutra
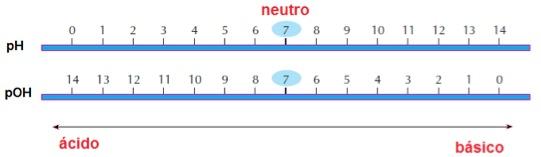
Baseando-se nesse conhecimento, o bioquímico dinamarquês Soren Sorensen criou duas definições muito importantes: pH (potencial hidrogeniônico) e pOH (potencial hidroxiliônico). Tais conceitos foram criados porque os números que determinam o caráter ácido-base das soluções são expressos com expoentes negativos (10-7, 10-2), o que torna o cálculo mais complexo. A partir disso, Sorensen sugeriu a aplicação de logaritmos para converter esses valores em números mais fáceis de se trabalhar. Para calcular o pH e/ou o pOH de uma solução, utilizamos a seguintes expressões matemáticas:
Se uma solução apresenta, por exemplo, [H+] = 10-3 será classificada como ácida, pois terá um pH = 3. Enquanto uma solução que tem [OH-] = 10-4 é básica, pois apresenta pOH = 4. As soluções neutras têm pH e pOH = 7. Resumindo:pH + pOH = 14
 Naturalmente, a escala de pH do que a escala de pOH por ser mais simples.
Naturalmente, a escala de pH do que a escala de pOH por ser mais simples.
H2O(ℓ)
 H+(aq) + OH-(aq)
H+(aq) + OH-(aq)Em estado liquido, uma pequena parte das moléculas de água se dissocia, dando origem aos íons H+ e OH- aquosos. Na reação inversa, esses mesmos íons se combinam e produzem novamente a água líquida. Assim, dizemos que o comportamento da água pura caracteriza uma situação de equilíbrio, que recebe o nome de equilíbrio iônico da água.
Por se tratar de um caso de equilíbrio iônico, podemos determinar a constante de equilíbrio da água, ou seja, a razão entre as concentrações dos seus produtos sobre a concentração dos seus reagentes. Veja:
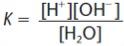
Kw = [H+][OH-]
Kw = 10-7 . 10-7 = 10-14 (a 25 °C)
Mas, por que não aparece a concentração da água no cálculo que fizemos? A resposta é simples: a concentração da água é absolutamente constante (isso pode ser facilmente compreendido se pensarmos que não existe água concentrada nem água diluída). O resultado que obtivemos a partir do cálculo é o que chamamos de produto iônico da água, representado pelo símbolo Kw (K vem de constante e w de water, água em inglês).
Perceba que, na água pura, a concentração de H+ (1 x 10-7) é igual à concentração de OH- (1 x 10-7), por isso dizemos que a água pura é neutra a temperatura ambiente. Quando, porém, a concentração de íons H+ é maior que a concentração de OH- de uma solução, dizemos que se trata de uma solução ácida. Ao contrário, quando uma solução apresenta uma concentração de OH- maior que a de H+, dizemos que ela é uma solução básica.
Quanto maior a concentração de H+ mais ácida será a solução
Quanto maior a concentração de OH- mais básica (ou alcalina) será a solução
Quando as concentrações de H+ e OH- são iguais, a solução será neutra
Baseando-se nesse conhecimento, o bioquímico dinamarquês Soren Sorensen criou duas definições muito importantes: pH (potencial hidrogeniônico) e pOH (potencial hidroxiliônico). Tais conceitos foram criados porque os números que determinam o caráter ácido-base das soluções são expressos com expoentes negativos (10-7, 10-2), o que torna o cálculo mais complexo. A partir disso, Sorensen sugeriu a aplicação de logaritmos para converter esses valores em números mais fáceis de se trabalhar. Para calcular o pH e/ou o pOH de uma solução, utilizamos a seguintes expressões matemáticas:
| pH = -log [H+] pOH = -log [OH-] |
Veja alguns exemplos:
| [H+] = 10-3 mol L-1 pH = -log [H+] pH = -log 10-3 pH = - (-3) . log 10 pH = 3 | [OH-] = 10-4 mol L-1 pOH = - log [OH-] pOH = - log 10-4 pOH = -(-4) . log 10 pOH = 4 |
Se uma solução apresenta, por exemplo, [H+] = 10-3 será classificada como ácida, pois terá um pH = 3. Enquanto uma solução que tem [OH-] = 10-4 é básica, pois apresenta pOH = 4. As soluções neutras têm pH e pOH = 7. Resumindo:pH + pOH = 14
| Soluções ácidas | Soluções neutras | Soluções básicas |
| pH < 7 pOH > 7 Ex.: suco gástrico, vinagre, suco de limão. | pH = 7 pOH = 7 Ex.: água pura, sangue humano, saliva. | pH > 7 pOH < 7 Ex.: leite de magnésia, água do mar, cremes dentais. |


Nenhum comentário:
Postar um comentário